
滴眼给药毒性试验2-药物眼部暴露与安全性评价
在上一篇滴眼给药毒性试验1中,咱们一起了解了其目的与试验设计,今天咱们继续,看看这篇综述中关于滴眼给药的眼部暴露,以及局部和全身安全性评价的内容。
眼部暴露
滴眼给药毒性试验的供试品标准浓度从0.001%到10%(即0.01 mg/mL至100 mg/mL)不等。滴眼液滴入眼睛后会被泪液稀释,并在一定程度上受到泪膜的阻滞,尤其是对于蛋白结合率高的供试品。然而,眼表各组织(如结膜和角膜上皮)的供试品浓度却非常高。
相反,房水的药物生物利用度通常低于10%。已有多位研究者探究了影响滴眼液吸收的因素。影响眼渗透性的药物化学特性包括:亲水性或亲脂性、离子化或去离子化、分子量、制剂中的供试品浓度以及制剂中的添加剂等。药物滴入眼睛后会分布到各个部分。其分布途径可简单地分成两种:(1)角膜途径和(2)结膜/巩膜途径。
最近,有研究者从视网膜/脉络膜给药的角度假设存在三种途径:
(1)(经角膜)穿过玻璃体的途径
(2)(经角膜)葡萄膜——巩膜的途径
(3)(经巩膜)眼周途径。各药物的分布取决于其理化性质,如图1所示。
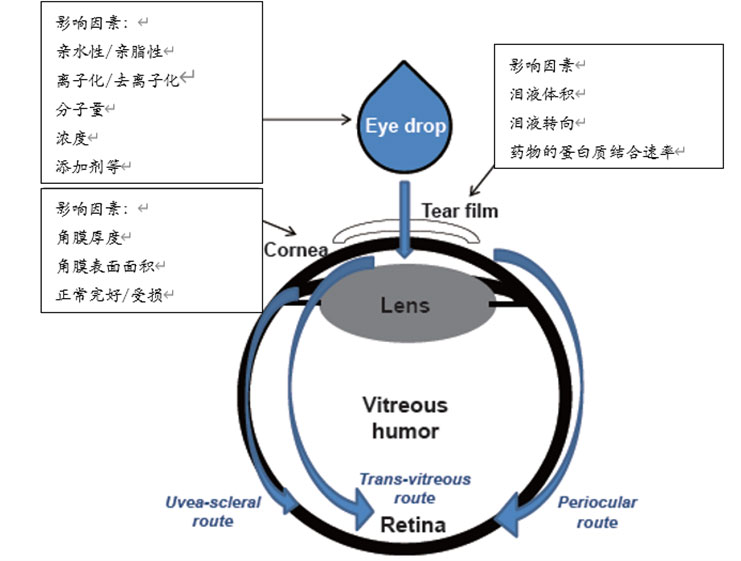
图1 影响眼部药物吸收的因素
动物的生理条件可能会影响眼毒性反应。由于药物浓度梯度限制了药物的吸收,角膜渗透主要取决于药物浓度。因此,如泪液体积发生变化,无论这种变化是否与供试品有关(如麻醉的影响),角膜对药物的吸收速率都会改变。已知眨眼会将药物从眼表排出,这意味着如眨眼频率发生变化,眼部毒性反应的严重程度也可能会发生变化。此外,如角膜上皮不完整(如角膜损伤),亲水性药物更容易进入眼内。这表明,一旦角膜上皮受损,眼部供试品的暴露水平将提高,毒性反应也会加重。
最近已有多篇关于眼内转运蛋白的文章发表。研究证实,角膜、虹膜-睫状体和视网膜/脉络膜等多个组织中存在转运蛋白。Zhang等人(2008)通过比较不同物种(家兔、犬、食蟹猴和人类)不同眼组织中转运蛋白基因表达水平的差异,发现人眼组织中的主要外排转运蛋白是多药耐药相关蛋白1(MRP1),主要的摄取转运蛋白是肽转运蛋白1(PEPT1),以及有机阳离子转运蛋白1(OCT1)、有机阳离子转运蛋白新型1(OCTN1)和有机阳离子转运体新型2(OCTN2)。转运蛋白对药物的眼部药代动力学和物种间特异性的影响有待进一步研究。
在眼睛滴入供试品后,眼后节的暴露水平远低于眼前节。这是因为视网膜上,尤其是视网膜后部,存在多个解剖和功能结构,这些结构会阻碍供试品的进入。尽管如此,某些滴眼液(如溴莫尼定、二氟泼尼酯和地塞米松等)在滴眼后仍能在视网膜上发挥药效。一项关于尼普地洛的研究表明,局部渗透的主要路径是药物滴入眼睛后,从后节眼周组织逐步扩散,穿过巩膜后部到达视网膜脉络膜后部。近年来,眼后节局部给药药物递送系统正在研发中。在眼后节给药药物的研发过程中,眼后节的安全性评估将变得更加重要。
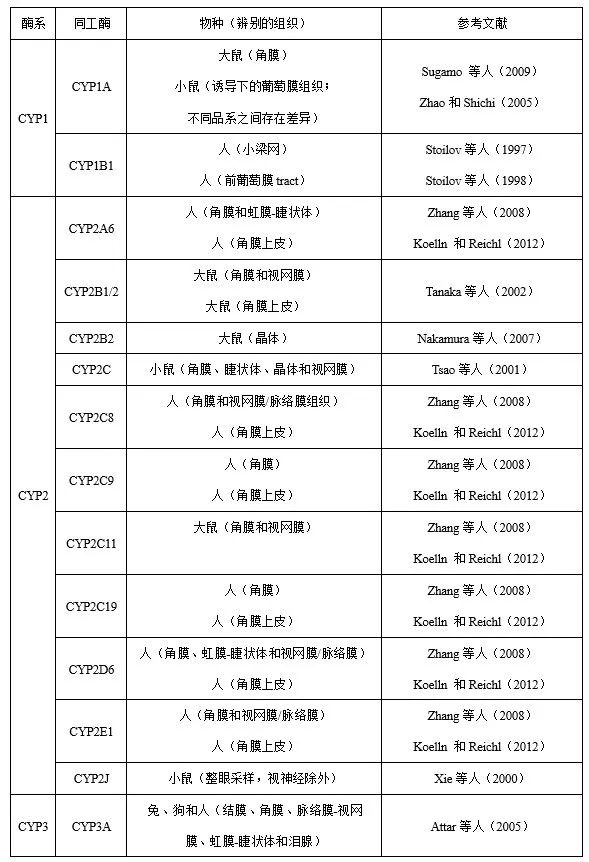
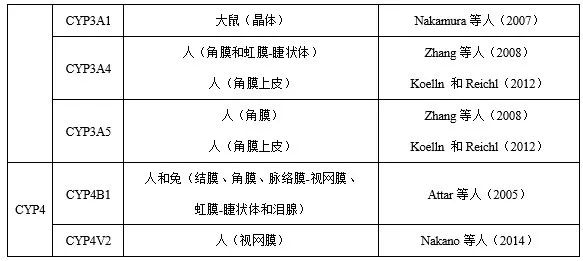
目前,已有多篇关于眼组织药物代谢的文章发表。研究表明,眼组织中检测到大量的细胞色素P450酶(CYP),见表1。然而,眼组织中这些酶的活性或基因表达水平远低于参与药物代谢的其他器官(如肝脏)的活性或水平。关于其他药物代谢酶,Attar等(2005、2013)引入了氧化还原酶(如醛氧化酶、酮还原酶、环氧化酶、单胺氧化酶)、水解酶(如氨肽酶、乙酰胆碱酯酶、丁酰胆碱酯酶、羧化酯酶、磷酸酶、芳基磺化酶、N-乙酰-β-氨基葡萄糖苷酶、β-葡萄糖醛酸酶)和结合酶(如芳胺乙酰转移酶和谷胱甘肽S-转移酶)。其中部分酶参与局部给药的药物代谢。然而,关于不同物种及不同眼组织中酶的差异,相关资料仍然很少。
表1 眼组织细胞色素P450酶系
与黑色素的亲和性是影响眼内药物毒理特征的另一重要因素。有研究者报告称,有色素动物的药效比白化动物的药效更轻微。如药物与黑色素结合,黑色素的含量可能会降低靶位点的自由药物浓度,从而导致药效减弱。反过来,药物与黑色素结合后可能会蓄积,然后逐渐释放,从而延长药效(即使是在停药后)。Leblanc等人(1998)认为,药物本身与黑色素结合并不会影响眼部毒性反应。因此,能与黑色素结合的药物的眼部毒性特征取决于药物的毒性、与黑色素的结合方式和接触时间(包括停药期)。
眼毒性和安全性评估
对于滴眼液制剂形式的供试品,其毒性可分为原发性毒性、脱靶毒性和化学品相关效应。由于局部给药位点处的供试品浓度较高,毒性反应主要发生在眼前节。因此,毒性反应最常见于角膜、结膜、虹膜和眼周组织/器官(如眼睑、皮肤和泪腺)。实际上,随着多款眼表滴眼液的上市,已有多起不良事件被报道。
角膜、结膜和眼睑
基于预试验(如体外细胞毒性试验),从诸多细胞毒性较弱的供试品中选出适合的供试品,开展滴眼给药毒性试验,以支持临床试验。此外,供试品的制剂也会根据临床人体试验所用制剂进行调整。因此,预计在滴眼给药毒性试验中不会出现化学烧伤或化学腐蚀等明显的毒性反应。
充血是OITSs和临床局部给药中常见的反应。如供试品具有扩张血管的效果,充血通常是暂时的,且不伴随组织病理学变化。然而,如充血是由组织损伤引起,则可伴随水肿和炎症。
角膜混浊在毒理学上具有重要意义,因其会干扰视力。因此,试验应设置恢复期,以探究角膜混浊的可逆性。角膜混浊的可逆性可因受损位置而有所不同。由于兔和人类的角膜上皮细胞在一周内能再生,如损伤区域仅限于角膜上皮和角膜中心,角膜混浊很可能会消失。相反,如角膜上皮的干细胞(如角膜缘)受损,角膜混浊可能难以复原。
由于角膜内皮在维持角膜内部液体平衡中发挥重要作用,因此角膜内皮损伤后,常发生基质水肿。角膜基质出现水肿、细胞浸润以及供试品或矿物质元素沉积,都可能导致角膜混浊。兔的角膜上皮具有再生能力,但成年灵长类动物或犬的角膜内皮却没有这种再生能力。因此,应认真评估兔角膜内皮的可逆性,并探究其与人类角膜上皮可逆性的相关性。无论如何,一旦基质受损,由于基质重塑速度缓慢,角膜透明度的恢复时间会相对较长。在这种情况下,纤维组织可能会修复基质损伤,但角膜透明度可能无法完全恢复。
滴眼液通常会标明与过敏相关的注意事项。然而,判断滴眼给药毒性试验中眼表炎症是否与过敏相关通常非常困难。可以利用其他非临床手段评估致敏风险,如小鼠局部淋巴结试验(OECD,2010)。
已知口服阳离子两亲性药物会引起动物和人类角膜磷脂沉积。Bockhardt等人(1978)报告了胺碘酮脂滴眼诱导大鼠类脂沉积。有研究者证实,给予兔滴眼液会导致角膜磷脂沉积。如果磷脂沉积与角膜混浊无关,且一直在组织病理学评估范围内,那么此镜检发现的毒理学意义可能不大。胺碘酮诱导的人体角膜磷脂沉积是可逆的,且对视力的损害很小。
泪液分泌减少会导致干眼症。已知几种滴眼液会引起泪液系统功能失调。因此,在评估角膜毒性反应时,应考虑泪膜的完整性。
葡萄膜
眼压会受到原发性药理作用(如青光眼治疗药物)、脱靶性药理作用、炎症引起的组织功能紊乱或损伤的影响。眼压持续升高可能会导致青光眼,进而引发功能性眼损伤,甚至视力损伤。
药物的原发性或脱靶性药理作用能引起散瞳或缩瞳,但这些效应通常是暂时的。散瞳或限制瞳孔收缩的药物会导致前房变浅和房角变窄,这些结构性变化可能会导致眼压升高。有研究者报告称,皮质类固醇会诱导人类眼压升高,但这种现象在动物身上并未重现。
某些滴眼液会导致虹膜变色。有研究者报告称,治疗青光眼的β阻断剂左布诺洛尔会引起人类虹膜褪色。Schafer和Render(2013a)认为,炎症可能会导致葡萄膜褪色。另一方面,类前列腺素会促进黑色素合成,导致虹膜色素沉着。在患者身上,这种色素沉着通常是永久性的。
晶状体
晶状体的前端正对着眼房,眼房内充盈着房水。这种结构使晶状体上皮能直接接触到眼房内的药物。有研究者报告称,人类晶状体混浊可能是药物局部应用引起的,例如抗胆碱酯酶、毛果芸香碱和乙酰胆碱。在动物实验中,发现晶状体混浊是由多重机制引发的,包括糖、蛋白质、脂质和电解质代谢异常。人类和动物的部分晶状体混浊是暂时性的,但受损晶状体组织的修复速度非常缓慢。Schafer 和 Render(2013b)认为,糖皮质激素诱导的人类白内障难以在动物模型中复现。
视网膜
许多药物和化学品可引起各种形式的视网膜毒性。如药物通过系统给药,视网膜毒性在非临床试验和临床试验中都较为常见;而局部给药则较少出现毒性反应。这很可能是由于局部给药时药物的生物利用度较低,尤其是眼后节,包括视网膜在内的生物利用度更低。然而,如上所述,有报告称某些滴眼液在眼后节也能发挥药理作用。因此,对视网膜进行OITSs眼科检查变得尤为重要,包括使用成像技术检测轻微的视网膜变化。
特异质药物不良反应
特异质药物不良反应(IDRs)被认为是可能致命的人体副作用,主要影响皮肤、肝脏和骨髓。有研究人员认为这些反应是由免疫介导的。根据George等人(2014)的表述,局部给药时出现Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN)的情况非常罕见。然而,已有案例报告显示,多佐胺/噻吗洛尔/拉坦前列素滴眼液可引起TEN(弗洛雷斯等人,2005),而磺胺甲恶唑滴眼液则可引发Stevens-Johnson综合征。因此,在未来的非临床试验中,应考虑对特异质药物不良反应进行安全性评估。
局部和系统未观察到有害作用水平
在滴眼给药的毒性试验中,局部和系统未观察到有害作用水平应分别定义。Lewis等人(2002)建议,在局部给药试验中,应建立两种未观察到有害作用水平:一种基于局部(给药部位)药效,另一种基于系统药效。OITSs的局部毒性反应和系统毒性反应通常不会相互影响。然而,如果动物状况不佳,系统毒性可能会影响眼科检查结果。
计算机模拟预测眼部暴露量和眼毒性风险评估
测量人体眼组织的药物暴露水平是不现实的。即使能测量实验动物眼组织的药代动力学参数,也需要大量动物才能进行全面分析。计算机模拟的最新进展或许能够解决这一困境。例如,Tojo(2004)建立了眼部给药的药代动力学模型。有研究者报告使用计算机模拟了兔子滴眼给药后眼前节组织的药物渗透情况。此外,Ueda等人(2010)建立了正常眼和患病眼中抗菌药物的眼部扩散模型。这些模拟模型和计算机预测有助于估算人体和动物的眼部暴露量,并为未来技术发展提供了挑战和机遇。
滴眼给药毒性试验的系统毒性
全身器官检查OITSs的系统毒性评估与通过系统给药的一般毒性试验的系统毒性评估基本一致。Weir和Wilson(2013)总结了眼毒性试验的系统终点,具体检查项目包括:临床观察、体重、摄食、临床病理、剖检、脏器称重、组织病理学、毒代动力学(TK)和免疫原性(生物学)。基于既往的知识和经验,活体阶段的系统检查(不包括前章所述的眼科检查)如表2所示。其中,心电图和血压测量是猴和犬系统给药的一般毒性试验的常规检查。由于滴眼液的副作用常见于心血管系统,因此OITSs也需要进行相关参数的检查。
表2 滴眼给药毒性试验中活体阶段的系统检查(除眼科检查外)

与系统给药的一般毒性试验类似,在滴眼给药毒性试验中也会对全身器官进行组织病理学检查,这对评估全身器官的毒性具有重要意义。然而,如系统给药的单个毒性试验已确定未观察到有害作用水平(NOAEL),且药代动力学(TK)数据有效,那在滴眼给药毒性试验中对全身器官进行组织病理学检查可能意义不大。
毒性相关的系统暴露量的考量
与系统给药的药物相比,滴眼液的系统暴露水平相对较低。举例来说,若双眼每天滴入3次1%的滴眼液(假设每滴体积为40 µL,体重60 kg),可算出剂量水平为0.04 mg/kg/day。滴眼液的系统生物利用度通常高于75%,或20%至100%不等。相较于其眼内生物利用度,系统生物利用度相对较高。绝大部分滴眼液会流入鼻泪管并粘附在鼻黏膜上。在这个过程中,滴眼液被吸收并进入系统循环。Lee等人(1993)报告称,至少50%的药物通过鼻黏膜经系统吸收进入血液。因此,眼科滴眼药物的药代动力学与静脉注射药物的药代动力学相似,两者都较少受到首过效应的影响。一项使用噻吗洛尔的研究表明,人体静脉注射和滴眼给药的系统生物利用度和心肺效应相似。
毒代动力学在评估滴眼给药毒性试验的系统毒性方面非常重要。此外,在单侧滴眼给药时,TK数据有助于解释对照眼的眼科检查结果。目前,药物浓度检测的生物分析技术正不断发展,能够检测到10 pg/mL甚至更低的药物浓度。这项技术的进步有助于更准确地评估OITSs和人体临床试验的药代动力学特征,从而确定系统毒性的安全边际。
系统毒性反应和安全性评估
在滴眼液的临床和非临床试验中,系统毒性反应和副作用都非常罕见。青光眼治疗药物引起的系统副作用主要影响心血管系统和中枢神经系统。因为滴眼液的剂量水平并不会根据受试者的体型而进行调整,所以体型较小的人群(如儿童)出现系统副作用的风险相对较高。此前已有多起滴眼液诱导儿童产生系统副作用的案例,例如阿托品、环戊酮和散瞳剂。
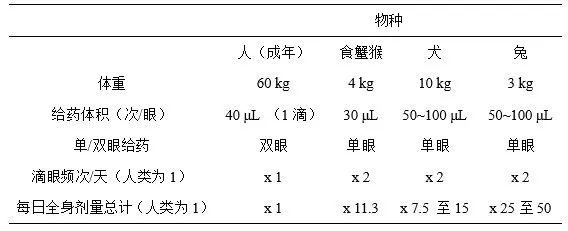
在眼科滴眼给药毒性试验(OIITSs)中,系统剂量水平/体重远远高于临床试验,这是因为所用的猴和兔的体重约为3至4 kg。即使所用制剂的药物浓度相同(表3),猴和兔的日用系统剂量是人体的7.5至50倍。如果提高药物浓度或增加给药频次,OIITSs的系统剂量水平将会与ICH M3指导原则(ICH, 2009)建议的最高剂量水平(意味着暴露量是临床剂量的50倍)持平。因此,在某些情况下,OIITSs适用于评估人体临床试验所用药物的系统毒性反应。总体而言,如在OIITSs中增加系统毒性反应评估和系统毒代动力学(TK)评估,非临床试验就无需包括单独的系统毒性试验。这种做法符合动物伦理委员会提出的3R原则(ILAR, 2011)。然而,关于是否需开展单独的毒性试验以评估系统毒性反应的合理性,仍需进一步讨论。
表3 临床人体试验和滴眼给药毒性试验的相对系统剂量水平
结论
本篇综述旨在在介绍滴眼给药毒性试验,引起研究人员对这类特殊性试验某些要点的关注。滴眼给药毒性试验的特点之一在于眼球直接给药。在开展此类试验时,毒理学家需认真设计试验,制定安全性评价策略,将滴眼液的所有特征纳入到考虑范围内。


