
啮齿类实验动物常见的鞭毛虫
鞭毛虫属于原虫,即具有独立完成生命活动的单细胞真核生物,在生物学分类上隶属于肉足鞭毛门,鞭毛亚门,动物鞭毛纲。鞭毛虫顾名思义,鞭毛为其特征,滋养体阶段有一根或多根鞭毛,但也有些特殊种类为阿米巴型,会存在无鞭毛形态。本篇将介绍啮齿类动物中常见的鞭毛虫。
啮齿类实验动物常见的肠道鞭毛虫
01毛滴虫
毛滴虫隶属于毛滴虫目(Trichomonadida),毛滴虫科(Trichomonadidae),该科分为两个属,毛滴虫属(Trichomonas)和三毛滴虫属(Tritrichomonas)。目前已知至少有四种毛滴虫可以感染啮齿类动物,包括小鼠三毛滴虫(Tritrichomonas musculis)、人五毛滴虫(Pentatrichomonas hominis)、鼠三毛滴虫(Trichomonas muris)和微小三毛滴虫(Tritrichomonas minuta)。其中鼠三毛滴虫是啮齿类实验动物最常见的鞭毛虫,它具有滋养体和假包囊两种存在形式。其滋养体大小约18~24umx12~14um,呈梨形;假包囊呈球形,直径约8um~13um。
包囊是原虫在其生活阶段中,由虫体本身形成的一层较厚的外膜,具有较强的抵抗作用;当这个外膜并非由虫体本身形成,而是来源于宿主,则称为假包囊。在生活期或运动期,吸取外界营养而生长的虫体,称为滋养体。滋养体较脆弱,无法在转移宿主过程中存活,通常不具有传染性。鼠三毛滴虫的假包囊是它的感染阶段,假包囊对干燥的环境抵抗不佳,一般存活不超过48h。
鼠三毛滴虫的感染途径是动物摄入或接触到含有假包囊的粪便或垫料等,假包囊进入到体内后,由消化液等作用转化为滋养体,滋养体在盲肠中增殖;滋养体进入到结肠后,由于环境干燥,再次转化为假包囊,随后排出体外。有资料显示,在盲肠中滋养体和假包囊比例约为8:1,在结肠中滋养体和假包囊比例约为1:1。因此,在动物排出的粪便中,多数检测到的都是假包囊。虽然鼠三毛滴虫一直以来被认为是非致病性鞭毛虫,但也有资料显示鼠三毛滴虫可引起实验动物的厌食和腹泻。
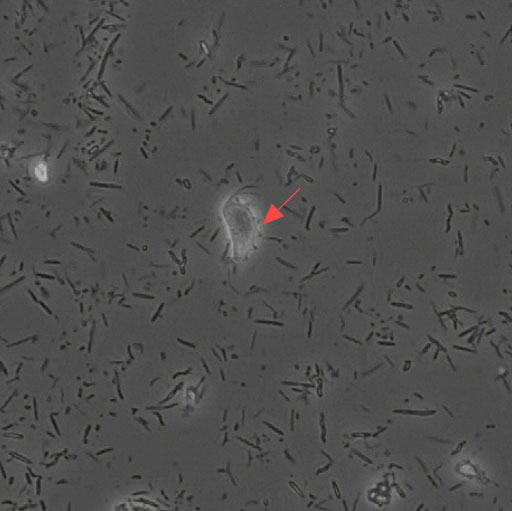
40× 红色箭头为鼠三毛滴虫,可见明显波动膜
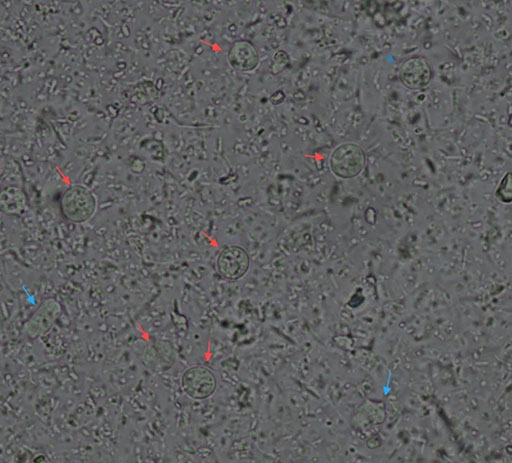
40× 红色箭头为毛滴虫伪包囊,蓝色箭头为滋养体
02贾第鞭毛虫
贾第鞭毛虫在生物学分类上隶属于双滴目(Diplomonadida),六鞭科(Hexamitidae),贾第属(Giardia),属于致病性鞭毛虫。贾第属的形态很相似,但具有种属特异性,因此根据宿主而分为不同的虫种。感染啮齿类动物的虫种有肠贾第鞭毛虫(又称十二指肠贾第鞭毛虫或蓝氏贾第鞭毛虫)(Giardia intestinalis/duodenalis/lamblia)、仓鼠贾第鞭毛虫(G. cricetidarum)、鼠贾第鞭毛虫(G. muris)和微小贾第鞭毛虫(G. microti)。肠贾第鞭毛虫根据其基因型被分为8个型,其中G型会感染啮齿动物。
贾第鞭毛虫具有滋养体和包囊两种时期,滋养体呈典型的倒置梨形,呈“落叶”式运动;包囊呈卵圆形,长8~10um,宽7~10um。由于虫体可在包囊内增殖,所以有时可在包囊内看见两个或四个核。滋养体是其生长、发育和增殖期;四核的包囊则为感染期。贾第鞭毛虫通过摄入或接触含包囊的粪便或饮用水等进行传播,包囊进入消化道内,经胃酸刺激包囊会生成两个滋养体;当滋养体到达空肠时,又转化成包囊。一般正常动物感染贾第鞭毛虫症状不明显,有时会出现体重减轻,毛发粗糙等症状;但可能会导致免疫缺陷动物死亡。
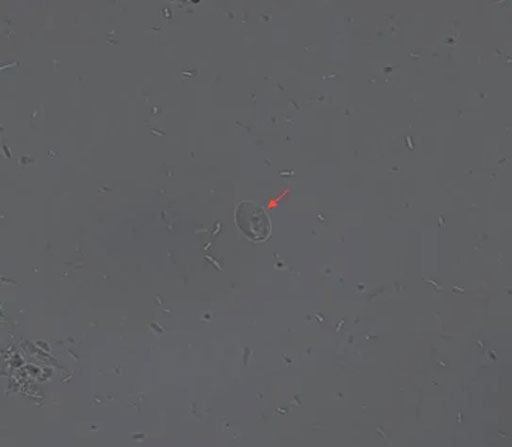
40× 红色箭头为贾第鞭毛虫包囊
03鼠六鞭毛虫
鼠六鞭毛虫(Spironucleus muris,旧称Hexamita muris)在生物学分类上隶属于双滴目(Diplomonadida),六鞭科(Hexamitidae),六鞭属(Hexamita)。鼠六鞭毛虫具有滋养体和包囊两种时期,滋养体呈细长梨形且两侧对称,约7~9umx2~3um,呈直线快速运动;包囊呈椭圆形,约4x3um,包囊最多可含四个核。鼠六鞭毛虫的生活史与贾第鞭毛虫相似,体型比贾第小很多。
鼠六鞭毛虫感染成年鼠和免疫功能正常鼠后一般无明显症状;但对于3-6周小鼠,易出现慢性肠炎、体重减轻等症状,更严重的会导致小鼠死亡。小鼠和仓鼠的鼠六鞭毛虫可以相互传播,但大鼠的鼠六鞭毛虫具有种属特异性。
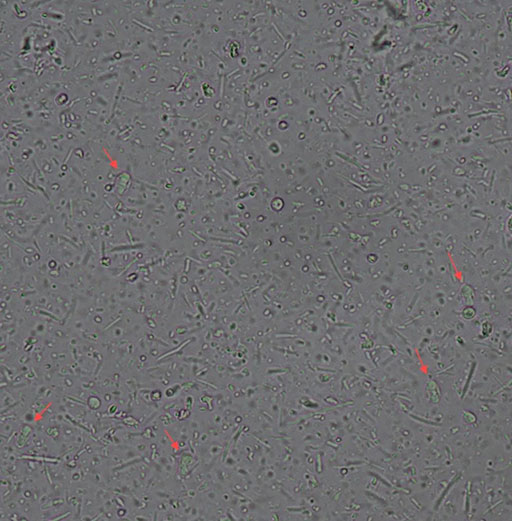
40× 红色箭头为鼠六包囊
04唇鞭毛虫
唇鞭毛虫在生物学分类上隶属于旋滴目(Retortamonadida),旋滴科(Retortamonadidae),唇鞭毛虫属(Chilomastix)。该属目前已报道约29种,形态相似。鼠唇鞭毛虫(Chilomastix bettencourti)寄生于啮齿动物盲肠中,具有滋养体和包囊两个时期,包囊是感染期。滋养体呈梨形,约8.3~20.9umx6.6~8.4um;包囊呈柠檬型,约15x7um。肠唇鞭毛虫(Chilomastix intestinalis)寄生于豚鼠,也具有滋养体和包囊两个时期。
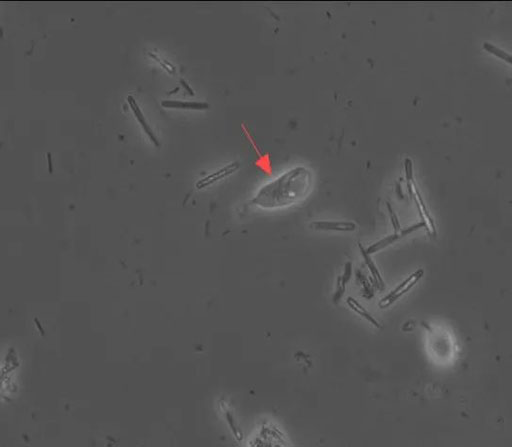
40× 红色箭头为鼠唇鞭毛虫
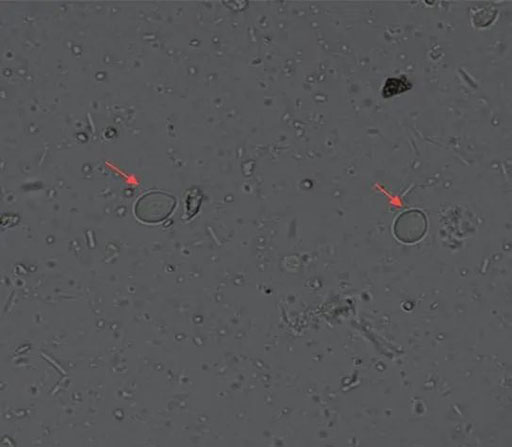
40× 红色箭头为唇鞭毛虫包囊
旋滴科的另一代表属为旋滴虫属(Retortamonas),这一属形态和唇鞭毛虫属很相似,在豚鼠中发现过。如豚鼠内滴虫(Retortamonas caviae),具有滋养体和包囊两种时期,滋养体呈梨形,约4~7umx2.4~4.3um;包囊呈柠檬状,约4.2x3.5um。
05其他鞭毛虫
还有一些不常见的鞭毛虫,如小鼠中曾发现过的仓鼠四毛滴虫 (Tetratrichomonas microti)以及豚鼠中曾发现的脱莫室滴虫( Oikomonas termo)、奥古旋滴虫( Spiromonas augusta)和活动豚鼠毛滴虫( Caviomonas mobilis)等。但目前仅有资料对这些鞭毛虫的形态进行描述,其致病性及防治方面研究甚少。
鞭毛虫的检测
在进行鞭毛虫检测时,对于一些滋养体状态的鞭毛虫,镜检法可容易检出;但对于一些假包囊和包囊状态的鞭毛虫,就需要检测人员有一定的经验积累。根据上述部分鞭毛虫的生活史,在镜检时应尽量选择新鲜回盲肠内容物,可通过辨认滋养体,从而提高检出率。
核酸检测技术目前也常用在鞭毛虫的检测中,如PCR、qPCR、巢式PCR、LAMP技术等。PCR方法可以通过扩增鞭毛虫18S rRNA、16S rRNA、5.8s rRNA和ITS等保守基因,对鞭毛虫达到种水平鉴定。但由于实验动物感染鞭毛虫的多样性,对引物要求较高。因此,核酸检测技术在鞭毛虫的鉴定分类应用上还有很大的发展空间。
鞭毛虫对动物的影响
虽然大部分鞭毛虫均显示对啮齿类实验动物无致病性,但这些鞭毛虫对啮齿类实验动物的行为改变和免疫状态改变均应当引起重视。目前也有越来越多的研究显示,鞭毛虫可以影响啮齿类实验动物细胞因子的分泌;对实验动物部分生理生化指标的影响;引起动物肠道炎症等。
鞭毛虫的预防和控制
规范动物房饲养流程,对进出人员进行培训管理,可以一定程度上预防鞭毛虫传播。动物房应当建立控制虫害管理程序,野生的啮齿动物携带很多寄生虫,具有很大的潜在风险。首先一定要保证动物饮水和饲料的洁净度;选择合适饲料,保证动物营养,从而增加免疫力;动物饲养流程规范,避免不当操作而引起鞭毛虫传播;引入动物来源稳定,避免引入疫区动物而污染屏障设施;不同等级动物分区饲养,避免交叉污染;增加对设施内动物质量监测频率,都可以对鞭毛虫的传播起到预防作用。
在发现阳性动物后,应迅速隔离阳性动物并进行筛查,防止扩散传播。在饮用水中加入硝基咪唑类药物,如甲硝唑和替硝唑,可以对鞭毛虫起到控制作用,但并不能完全清除;近年来有一些研究证明甲硝唑对大鼠和小鼠有致癌致突变性,替硝唑副作用较小。贾第鞭毛虫还可以选择芬苯达唑、甲苯达唑和阿苯达唑。但若想对设施内鞭毛虫进行完全清除,建议筛查并淘汰阳性动物。淘汰阳性动物后,应及时清理污染的粪便及垫料,并进行无害化处理;对污染的笼具可进行高温灭菌处理。
一般鞭毛虫对消毒剂都比较敏感,可使用季铵盐类消毒剂对房间进行定期消毒处理,也可有效控制鞭毛虫传播。鞭毛虫的包囊和伪包囊对干燥环境比较敏感,在干燥环境中存活时间较短,同时该时期也是大部分鞭毛虫的感染期。保持动物饲养环境干燥,也可以对鞭毛虫传播起到控制作用。
如需彻底清除鞭毛虫,可以使用剖腹产技术和胚胎移植技术达到净化目的。


